Pengertian Titrasi Argentometri, Faktr-faktornya & Metodenya
Pengertian Titrasi Argentometri - Salah satu jenis dari titrasi pengendapan yang telah lama dikenal yaitu melibatkan reaksi pengendapan antara ion halida (Cl-, I-, Br-) dan ion perak Ag+. Biasanya titrasi ini dikenal dengan sebutan Titrasi Argentometri. Dasar darti titrasi argentometri yaitu pembentukan endapan yang tidak mudah untuk larut antara titran dengan analit. Sebagai contoh yang paling banyak digunakan ialah titrasi penentuan NaCL dimana ion Ag+ dari titran akan bereaksi dengan ion Cl- dari analit membentuk garam AgCl yang tidak mudah larut. Lalu apa apa itu titrasi argentometri? Sudah tahukah kamu apa yang dimaksud dengan titrasi argentometri? Untuk teman-teman yang belum tahu maka di sini kami akan memberikan penjelasan tentang definisi titrasi argentometri.
Pengertian Titrasi Argentometri
Argentometri merupakan istilah yang diturunkan dari bahasa latin yaitu Argentum yang artinya perak. Titrasi Argentometri sering kali disebut sebagai Titrasi Pengendapan. Jadi argentometri itu merupakan salah satu cara yang digunakan untuk menentukan kadar zat dalam suatu larutan yang dilakukan dengan tritasi berdasarkan pembentukan endapan dengan ion Ag. Lalu apa itu titrasi argenometri? Titrasi argentometri adalah teknik khusus yang digunakan untuk menetapkan perak dan senyawa halida. Penetapan kadar zat analit didasari oleh pembentukan endapan.
Atau definisi titrasi argentometri yaitu penetapan kadar zat yang didasari atas adanya reaksi pembentukan endapan dari komponen zat uji dengan titran larutan titer perak nitrat. Atau yang dimaksud titrasi argentometri ialah titrasi yang melibatkan pembentukan endapan dari garam yang tidak gampang larut antara titran dengan analit.
Faktor yang Mempengaruhi Kelarutan dalam Titrasi Pengendapan
Terdapat beberapa faktor yang mempengaruhi kelarutan dalam titrasi pengendapan/ titrasi argentometri.
- Temperatur, kelarutan akan bertambah jika temperatur mengalami kenaikan.
- Efek ion sejenis, kelarutan endapan dalam air berkurang apabila larutan itu mengandung satu dari ion-ion yang menyusun endapan.
- Sifat pelaut, garam anorganik lebih larut di dalam air, berkurangnya kelarutan di dalam organik bisa dipakai sebagai dasar dalam pemisahan dua zat.
- Pengaruh pH, larutan garam dari asam lemah itu bergantung dari pH larutannya.
- Efek ion-ion lain, endapan dapat bertambah kelarutannya jika dalam larutan ada garam yang beda dengan endapan.
- Pengaruh kompleks. Kelarutan dari garam yang sedikit larut adalah fungsi konsentrasi zat lain yang membentuk kompleks dengan kation garam tersebut.
- Pengaruh hidrolisis, apabila garam dari asam lemah dilarutkan ke dalam air, maka dapat menghasilkan (H), kation dari spesies garam akan mengalami hidrolisis sehingga kelarutannya bertambah.
Macam macam Metode Titrasi Argentometri
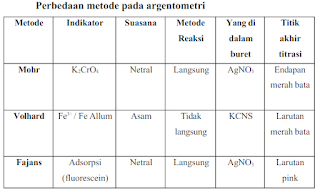
Terdapat macam macam metode titrasi argentometri yang dikembangkan, yaitu metode Mohr, Volhard, dan FAjans.
1. Titrasi Argentometri Metode Mohr
Metode mohr pada titrasi argentometri yaitu metode yang terbatas untuk lartutan dengan nilai pH sekitar 6 hingga 10. Perak oksida akan meengndap dalam larutan yang lebih basa.
Kegunaan dari metode Mohr adalah sebagai penetapan kadar Bromida atau Klorida. Prinsip penetapannya larutan bromida atau klorida dalam keadaan netral atau agak alkalis diitrasi dengan larutan perak nitrat dengan indikator kromat. Jika ion bromida atau klorida sudah habis diendapkan oleh ion perak, maka ion kromat akan bereaksi dengan ion perak membentuk endapan perak kromat yang warnanya coklat meerah sebagai titik akhir titrasi. Larutan standarnya ialah larutan perak nitrat dengan indikator larutan kalium kromat.
2. Titrasi Argentometri Metode Volhard
Metode volhard adalah metode yang pertama kali diperkenalkan pada tahun 1874 oleh Jacobus Volhard, yang merupakan seorang ahli kimia dari Jerman. Metode volhard pada titrasi argentometri larutan standar AgNO3 berlebih ditambahkan ke dalam larutan yang didalamnya terkandung ion halogen (contohnya Cl-). Kelebihan dari ion Ag+ dalam keadaan asam dititrasi dengan standar garam tiosianat (NH4SCN atau KSCN) menggunakan indikator larutan Fe3+. Hingga titik ekivalen, terjadi sebuah reaksi antara titran dan Ag+ membentuk sebuah endapan putih. Jika titran kelebihan maka dapat menyebabkan reaksi dengan indikator membentuk senyawa kompleks tiosianato ferrat (III) yang warnanya merah.
3. Titrasi Argentometri Metode Fajans
Metode fajans dalam argentometri sama halnya dengan pada metode Mohr, perbedaannya hanya pada jenis indikator yang dipakai. Indikator yang dipakai dalam metode fajans yaitu indikator adsorpsi seperti fluonescein atau cosine menurut macam anion yang diendapkan oleh Ag+. Titrannya yaitu AgNO3 sampai suspensi violet menjadi merah. pH tergantung dari macam anion dan indikator yang digunakan. Indikator adsorpsi yaitu zat yang bisa diserap oleh permukaan endapan dan menyebabkan timbulnya warna. Pengendapan tersebut bisa diatur supaya terjadi di titik ekuivalen antara lain dengan cara menentukan macam indikator yang digunakan dan PH. Sebelum titik ekuivalen dapat tercapai, ion Cl- ada dalam lapisan primer dan sesudah tercapai ekuivalen maka akan kelebihan sedikit AgNO3 yang menyebabkan ion Cl- digantikan Ag+ sehingga ion Cl- berada dalam lapisan sekunder.
Cara Penetapan Titik Akhir dalam Reaksi Pengendapan (Argentometri)
Terdapat 3 macam cara penetapan titik akhir dalam reaksi pengendapan, diantaranya yaitu sebagai berikut:
1. Pembentukan Suatu Endapan Berwarna
Bisa diilustrasikan dengan mohr untuk penetapan bromide dan klorida. Dalam titrasi sebuah larutan netral dari ion klorida dengan larutan perak nitrat, sedikit ditambahkan larutan kalium kromat sebagai indikator. Di titik akhir, ion kromat bergantung dengan ion perak untuk membentuk perak kromat merah yang hanya sedikit bisa larut. Hendaknya titrasi ini dilakukan ketika suasana netral atau sedikit basa, yaitu dalam jangkauan pH 6,59.
2. Pembentukan Sebuah Senyawa yang Berwarna dan Bisa Larut
Contoh dari cara ini yaitu pada metode volhard untuk tritasi perak dengan terdapatnya asam nitrit bebas dengan larutan kalium atau ammonium tiosianat standar. Indikatornya yaitu larutan besi (III) amonium sulfat. Dengan penambahan larutan tiosianat maka dapat menghasilkan mula-mula endapan perak klorida. Kelebihan dari tiosianat yaitu meskipun sedikit dapat menghasilkan pewarnaan coklat kemerahan, hal itu dikarenakan terbentuknya sebuah ion kompleks.
Cara ini bisa diterapkan untuk menetapkan klorida, bromide dan iodide dalam larutan asam. Larutan perak nitrat standar berlebih ditambahkan dan kelebihannya dititrasi balik dengan larutan tiosianat.
3. Penggunaan Indikator Adsorpsi
Aksi dari indikator adsorpsi yaitu disebabkan sebuah fakta kalau pada titik ekuivalen, indikator itu diadsorpsi oleh endapan. Ketika proses adsorpsi terjadi sebuah perubahan dalam indikator yang menyebabkan suau zat dengan warna yang tidak sama, maka disebutlah indikator adsorpsi. Zat-zat yang dipakai yaitu zat-zat warna asam, seperti warna deret flouresein misalnya flouresein en eosin yang dipakai sebagai garam natriumnya.
Untuk tritasi klorida dapat digunakan flouresein. Sebuah larutan perak klorida dititrasi dengan larutan perak nitrat, maka perak klorida yang akan mengendap mengadsorpsi ion-ion klorida. Ion flouresein akan membentuk sebuah kompleks dari perak yang warnanya merah jambu.
Perbedaan Metode Mohr Volhard dan Fajans Pada Argentometri
Berikut ini adalah beberapa perbedaan metode dalam titrasi argentometri antara Metode Mohr, Volhard dan Fajan:
Dari ketiga metode tersebut yang paling stabil yaitu metode voland. Tetapi metode ini memakai asam sianida (HCN) yang sifatnya toxik.
Itulah penjelasan yang dapat kami berikan tentang apa Pengertian Titrasi Argentometri. Semoga penjelasan di blog temukan pengertian ini bisa memberikan manfaat bagi kita.